Aunque la forma usual en la cual se escribe la relación de incertidumbre para la posición y el momentum es la siguiente:
ΔxΔp ≥ ħ/2
existe otra forma de enunciar el principio de incertidumbre que ha ganado popularidad porque permite darle al principio de incertidumbre una interpretación estadística usando un término que nos es familiar: la desviación estandard σ, mediante la cual el principio de incertidumbre se escribe de la manera siguiente:
σxσp ≥ ħ/2
Esta interpretación al principio de incertidumbre fue dada por el físico norteamericano Earl H. Kennard en 1927, al poco tiempo de haber anunciado Heisenberg al mundo el descubrimiento del principio de incertidumbre obtenido y formulado mediante un tratamiento matricial, y es la interpretación que utilizaremos cuando tratemos el tema de la Mecánica Ondulatoria. De este modo, podemos establecer las siguientes comparaciones entre ambas interpretaciones:

Se debe resaltar como algo importante el hecho de que Δx y σx no son las mismas cantidades, aunque para fines prácticos terminen produciendo las mismas cantidades en los cálculos numéricos. Las cantidades σx y σx, como fueron definidas por Kennard, son obtenidas llevando a cabo mediciones repetidas sobre un gran ensamble de sistemas (la palabra usada en inglés es ensemble, y tomaremos esto como el mismo experimento repetido muchas veces bajo las mismas condiciones y anotando cuidadosamente los distintos valores que se vayan obteniendo para cada variable al ir pasando de un experimento a otro), calculando tras esto la desviación estandard estadística de esas mediciones sobre los valores obtenidos como resultado de cada medición. La expresión de Kennard, por lo tanto, no nos dice nada sobre la medición simultánea de la posición y el momentum, en la interpretación dada por Heisenberg al principio de incertidumbre según la cual no es posible medir al mismo tiempo con precisión ilimitada dos observables incompatibles tales como la posición y el momentum medidos a lo largo de una misma coordenada. Sin embargo, a la hora de los hechos, ambas interpretaciones coincidirán al llevarse a cabo la evaluación de los resultados experimentales. De este modo, si al evaluar las estadísticas de dos variables propias del mundo sub-microscópico tras repetir un mismo experimento cientos o miles de veces, vemos muy poca variación en una de ellas mientras que la otra exhibe una dispersión σ amplia de valores, llegaremos a la conclusión de que estamos obteniendo una incertidumbre muy pequeña en una de las variables a expensas de tener una incertidumbre mayor en la otra (interpretación estadística de Kennard), concluyendo por lo tanto que no es posible obtener simultáneamente una precisión ilimitada en ambas mediciones (interpretación de Heisenberg).
PROBLEMA: Determínese la incertidumbre en la posición de un fotón cuya longitud de onda es de 4000 Angstroms si su longitud de onda se puede medir con una precisión de una parte en un millón.

Si la longitud de onda λ es igual a 4000 Å, el momentum del fotón es entonces:
p = h/λ = hc/λc = (12400 eV·Å)/(4000 Å×c)
p = 3.1 eV/c
Podemos obtener la incertidumbre en el momentum del fotón de la siguiente manera:

Si la longitud de onda del fotón se puede medir con una precisión de una parte en un millón, entonces debemos tener Δλ/λ = 10-6, y en tal caso la incertidumbre en el momentum del fotón será:
|Δp| = p(Δλ/λ) = (3.1 eV/c)(10-6) = 3.1×10-6 eV/c
De este modo, usando el principio de incertidumbre podemos determinar la incertidumbre en la posición del fotón:
ΔxΔp ≥ ħ/2
Δx ≥ ħ/2Δp
Δx ≥ ħc/2cΔp
Δx ≥ hc/4πcΔp
Δx ≥ (12400 eV·Å)/(4πc×3.1×10-6 eV/c)
Δx ≥ 318×10-6 Angstroms
Δx ≥ 318 milímetros
PROBLEMA: Considérese el caso de una partícula sub-microscópica encerrada en una caja, confinada a moverse a lo largo de un solo eje coordenado en un tramo de trayectoria de longitud L y rebotando entre las dos paredes de la caja. Con la ayuda del principio de incertidumbre, calcúlese la energía mínima que puede tener una partícula encerrada en una caja.
Puesto que la partícula está encerrada dentro de una caja de largo L, la incertidumbre Δx en la posición de la partícula no puede ser mayor que dicha distancia L, lo cual implica que el momentum no puede ser menor que:

De la definición de la desviación estándard σ para cualquier conjunto de valores A, se tiene que el cuadrado de la desviación estándard σ de dicha cantidad es igual al promedio aritmético de los cuadrados de los valores de A menos el cuadrado de la media aritmética de los valores de A:
σ² = (ΔA)² = (A²) - (A)²
Aplicando esta relación a la incertidumbre en el momentum, se tiene entonces que:
(Δp)² = (p²) - (p)²
Si la caja es simétrica, entonces el promedio del momentum de la partícula deberá ser igual a cero, ya que la partícula debe estarse moviendo tantas veces “de izquierda a derecha” como “de derecha a izquierda”. Por lo tanto, haciendo:
p = 0
se tiene que:
(Δp)² = (p²)
Ahora bien, la energía cinética de una partícula es igual a:
E = p²/2m
y la energía cinética promedio de la partícula será:
E = (p²)/2m
o, por lo que obtuvimos arriba:
E = (Δp)² /2m
Puede verse entonces, aplicando el principio de incertidumbre como fue escrito al principio de este problema, que la energía mínima Emin de una partícula encerrada en una caja deberá ser:
Emin ≥ (ħ/2L)²/2m

Este es un resultado trascendental, ya que nos confirma que los sistemas ligados (en los cuales tenemos a una partícula encerrada no dentro de una caja sino dentro de algún “pozo de potencial” que le impide escapar) no pueden tener energía cero cuando se toma en cuenta el principio de incertidumbre. ¡Ni siquiera a la temperatura del cero absoluto!
PROBLEMA: Obténgase una estimación de la energía mínima que debe tener un neutrón que está confinado dentro de un núcleo de 10-14 metro de diámetro.
Usaremos el resultado obtenido en el problema anterior, modificándolo un poco para fines de manipulaciones numéricas recurriendo a constantes físicas conocidas:

Utilizando los siguientes valores el segundo de los cuales es la masa en reposo del protón:
ħc = 1973 eV·Å
mc² = 938.3 MeV
se puede dar la siguiente estimación para la energía mínima que debe tener un protón confinado dentro de un núcleo de 10-14 metro = 10-4 Angstrom:
Emin ≥ (1973)2/[8·(938.3×106)(10-4)2]
Emin ≥ (1973)2/[8·(938.3×10-2)]
Emin ≥ .052 MeV
PROBLEMA: Supóngase ahora que quisiéramos confinar un electrón dentro del núcleo de un átomo con el mismo radio dado en el problema anterior. Estímese la energía mínima que tendrá el electrón anticipando que en este caso se requerirá un cálculo relativista por ser mayor la energía del electrón que su masa en reposo para este tipo de problemas.
Del resultado obtenido para una partícula encerrada en una caja de dimensión L, el magnitud mínima del momentum será para el caso de una longitud L = 10-14 metro = 10-4Angstrom:
Δp = pmin ≥ ħ/2L
pmin ≥ h/4πL
pmin ≥ h/(4π·10-4 Å)
o bien:
pminc ≥ hc/(4π·10-4 Å)
pminc ≥ (12400 eV·Å)/(4π·10-4 Å)
pminc ≥ 9.87 MeV
Esta energía excede con creces la energía en reposo mec² del electrón que es igual a 0.511 MeV, lo cual nos obliga a utilizar las fórmulas de energía que nos proporciona la Teoría de la Relatividad. La relación relativista propia de la Teoría Especial de la Relatividad (consúltese la sección titulada “La ecuación más famosa de Einstein” de la obra “La Teoría de la Relatividad” del mismo autor de este trabajo) para la energía total E de la partícula siendo aquí Kmin la energía cinética de la partícula y siendo E0 la masa en reposo está dada por:
E² = (Kmin + E0)² = (pminc)² + E0²
Del mismo modo, la misma Teoría Especial de la relatividad nos dá la siguiente relación que podemos igualar con la anterior:
E² = (pminc)² + E0²
Para el caso del electrón, la masa en reposo es mc² = 0.511 MeV, por lo cual, poniendo valores:
(Kmin + 0.511 MeV)² = (9.87 MeV)² + (0.511 MeV)²
(Kmin + 0.511 MeV)² = 97.4 MeV + 0.26 MeV
Kmin = 9.37 MeV
En relación al resultado obtenido, cuando se observó por vez primera la emisión de los electrones de los núcleos (como rayos β) durante el proceso de desintegración radioactiva, al principio se creyó que los electrones emitidos estaban dentro del núcleo del átomo. Sin embargo, las energías de los electrones emitidos eran frecuentemente de unos pocos centenares de KeV y no el estimado mínimo de 9.37 MeV que hemos obtenido en este problema, concluyéndose entonces que los electrones no eran partes constitutivas del núcleo de los átomos.
Una pregunta interesante a la cual podemos tratar de darle respuesta mediante el principio de incertidumbre es la siguiente: ¿será posible “ver”, en principio, hacia el interior de un átomo?
De acuerdo con los fundamentos de la óptica, para poder “ver” hacia el interior de un átomo tenemos que utilizar luz cuya longitud de onda λ sea menor que el tamaño del átomo. Del principio de incertidumbre tenemos lo siguiente:

El producto pc es igual a la energía Eγ del fotón que se requiere, y por lo tanto:

Utilizando como punto de referencia el radio de la primera órbita del modelo de Bohr, el cual es a0 = 0.529 Angstrom, para poder “ver” hacia el interior del átomo utilizaremos una longitud de onda λ = 0.1 Angstrom, que haremos igual a Δx con lo cual:
ΔEγ ≥ ħc/2λ
ΔEγ ≥ (1973 eV·Å)/(2×0.1 Å)
ΔEγ ≥ 10,000 eV
La energía del fotón excede con creces la energía de ligazón entre el protón y el electrón en el átomo de hidrógeno, que es de 13.6 eV, de modo tal que un fotón con la energía requerida para poder “ver” hacia el interior del átomo desbarataría al mismo átomo cuyo interior estamos tratando de ver. Esto hace que el interior de un átomo se vuelva esencialmente inobservable, tal y como lo había postulado Heisenberg desde un principio.
PROBLEMA: A partir del principio de incertidumbre, obténgase la energía mínima que deberá tener un oscilador armónico simple compuesto de una masa conectada a un resorte con una constante de fuerza K.
La energía total del oscilador armónico simple es igual a la energía cinética de la masa en movimiento y la energía potencial, estando dada la suma de los dos términos por la relación:

La energía total del oscilador armónico simple es constante y por lo tanto igual a su valor promedio que es a su vez igual a los valores promedio de su energía cinética y su energía potencial:

Como en un problema anterior visto arriba, el promedio del momentum de la masa oscilante debe ser igual a cero ya que la masa se está moviendo tantas veces “de izquierda a derecha” como “de derecha a izquierda”, y si el punto central del movimiento del cuerpo situado a la mitad de los dos extremos del movimiento es el origen del sistema de coordenada-x entonces el promedio de la posición debe ser también igual a cero por simetría. Por lo tanto, tendremos lo siguiente para las incertidumbres en la posición y en el momentum del oscilador armónico simple:
(Δx)² = (x²)
(Δp)² = (p²)
Esto, junto al principio de incertidumbre:

nos permite escribir la energía del oscilador armónico simple en función de las incertidumbres primero como:

y tras esto como:

Cuando Δx es pequeño, el primer término que corresponde a la energía cinética se vuelve grande mientras que el segundo término que corresponde a la energía potencial se vuelve pequeño, y cuando Δx es grande el primer término se vuelve pequeño mientras que el segundo término se vuelve grande. El valor mínimo Emin de la energía del oscilador armónico simple se puede obtener tomando primero la derivada de la expresión anterior con respecto a Δx:

igualando tras esto a dicha derivada:

con lo cual obtenemos el valor que debe tener Δx para lograr la condición de la energía mínima:

Substituyendo esto en la expresión para la energía del oscilador armónico simple, obtenemos finalmente la energía mínima que podemos tener en un sistema físico de este tipo:

Al igual que como ocurrió con el caso de una partícula encerrada en una caja, tampoco puede haber energía cero para un oscilador armónico simple, el cual es un sistema ligado en donde el cuerpo no está libre de influencia externa alguna.
Es importante tomar nota del hecho de que no sólo la energía del oscilador armónico simple no puede tener energía cero, sino que los demás valores mayores de energía que pueda tomar el oscilador armónico simple no pueden tomar cualesquier valor, ya que la energía del oscilador armónico simple se encuentra cuantizada o discretizada. Sin embargo, el conocimiento acerca de la cuantización de las energías del oscilador armónico simple ya no nos viene del principio de incertidumbre, sino de la matriz que describe a la energía H de un oscilador armónico simple, resultando ser los eigenvalores de dicha matriz los valores de la energía que puede tomar el oscilador armónico simple, no encontrándose el valor de cero entre dichos eigenvalores.
PROBLEMA: Partiendo del principio de incertidumbre, demuéstrese que para una partícula que se mueve a lo largo de una circunferencia:
ΔLΔθ ≥ h/4π
siendo ΔL la incertidumbre en el momento angular y siendo Δθ la incertidumbre en el ángulo. ¿Qué implicaciones tiene este resultado para el modelo atómico planetario de Bohr?
En virtud de que la partícula se mueve a lo largo de una circunferencia, el principio de incertidumbre se aplicará al movimiento tangencial de dicha partícula a lo largo de un segmento de arco tomado como la trayectoria del movimiento:
 midiéndose el arco s a lo largo de la circunferencia. El momento (o momentum) angular está dado en función del movimiento lineal por la siguiente relación:
midiéndose el arco s a lo largo de la circunferencia. El momento (o momentum) angular está dado en función del movimiento lineal por la siguiente relación:
Entonces la incertidumbre en el momentum lineal medido sobre la trayectoria tangencial de la órbita será igual a Δpr = ΔL/R. Puesto que el desplazamiento angular en función del arco y del radio está definido por la relación θ = s/R, la incertidumbre en el arco será igual a Δs = RΔθ. Esto nos lleva a lo siguiente:

Aplicando esta substitución directamente en el principio de incertidumbre, llegamos a la relación que se desea demostrar:

Las implicaciones de este resultado sencillo sobre el modelo atómico planetario de Bohr son profundas y de gran alcance. Uno de los dos postulados del modelo atómico planetario de Bohr es que en las órbitas del electrón en su movimiento en torno al núcleo el momento angular L está cuantizado de una manera precisa. Puesto de otra manera, el electrón se encuentra en un estado de momento angular L fijo y la incertidumbre ΔL en el momento angular es por lo tanto igual a cero. Por consiguiente, si el principio de incertidumbre ha de mantenerse en pie, esto significa que la incertidumbre Δθ en la posición angular es infinita. Esto hace que la posición angular del electrón en su órbita en torno al núcleo esté completamente indeterminada. De esta manera, si en el modelo atómico planetario de Bohr era posible, al menos en principio, fijar en cada instante la posición del electrón alrededor del núcleo como en el caso de la órbita que corresponde al estado fundamental n = 1:

bajo el nuevo esquema esta imagen se desvanece en nuestras manos para ser substituída por otra imagen en la cual lo único que podemos afirmar acerca de la posición del electrón es que debe estar en algún lugar en torno al núcleo, una imagen difusa, “borrosa” por así decirlo:

Obsérvese que no sólo la posición angular del electrón en torno al núcleo es indeterminada, sino que también la distancia radial del electrón con respecto al núcleo pierde el valor preciso que se le había asignado e inclusive calculado en el modelo atómico planetario de Bohr, algo que puede anticiparse al aplicar el principio de incertidumbre a la parte radial de la descripción del átomo de Bohr. Lo único que nos viene quedando del electrón que forma parte de un átomo en el estado fundamental n = 1 es una imagen esférica, borrosa, a la cual se le dá una “forma” geométrica un poco más definida no sólo para el estado n = 1 sino para otros niveles energéticos dentro de la Mecánica Ondulatoria.
PROBLEMA: Si suponemos como válida la expresión clásica para la energía cinética de una partícula que se mueve en línea recta, demuéstrese que:
ΔEΔt ≥ ħ/4
en donde Δt = Δx/v.
De la expresión clásica para la energía cinética de una partícula moviéndose en línea recta:

al tomar diferenciales tenemos lo siguiente:

En este caso podemos usar incrementos finitos en lugar de infinitésimos para escribir lo siguiente:

Pero del principio de incertidumbre tenemos que ΔxΔp ≥ ħ/2. Entonces:

La relación que acabamos de obtener implica que no es posible medir en forma exacta la energía de un sistema a menos de que tengamos a nuestra disposición un tiempo infinito para llevar a cabo la medición.
PROBLEMA: Cuando un átomo está en un estado excitado no permanece mucho tiempo en ese estado, procurando irse a la configuración más estable pasando por los niveles intermedios de energía hasta llegar al estado fundamental. Este decaimiento es un proceso esencialmente estadístico, y tomamos el tiempo medio del decaimiento Δτ conocido comovida media como una medida del tiempo disponible para determinar la energía del estado. Para transiciones atómicas, Δτ tiene un orden de magnitud aproximado de 10-8 segundo. Determínese la incertidumbre en energía que corresponde a este tiempo.
Usando el resultado obtenido arriba y metiendo valores:
ΔEΔt ≥ ħ/2
ΔE ≈ ħ/2Δτ ≈ (4.136×10-15 eV·seg)/(10-8 seg)
ΔE ≈ 4.136×10-7 eV
A esta anchura en energía ΔE = Γ0 = ħ/2Δτ se le conoce como ancho natural del estado óancho natural de la línea (en la literatura inglesa se le conoce como “natural line width”). De cualquier modo, la incertidumbre cuántica implícita en la medición de estos parámetros no es el principal factor que contribuye a las anchuras de las líneas en el espectro de un elemento, ya que hay otros factores aún más importantes que producen una ampliación de la anchura de las líneas que obscurece la incertidumbre cuántica, tales como el retroceso del electrón (conocido en la literatura inglesa como recoil) y el efecto Doppler, así como las colisiones atómicas. Sin embargo, en algunos casos especiales tales como los átomos en sólidos a bajas temperaturas, las anchuras debidas al efecto Doppler y a las colisiones atómicas son esencialmente iguales a cero, y la única anchura observada es la anchura natural de la línea, produciéndose líneas extremadamente delgadas que proporcionan fotones con energía bien definida, siendo éste un efecto importante conocido como el efecto Mössbauer que es utilizado para experimentos de alta precisión tales como la confirmación de la Teoría General de la Relatividad de Einstein.
PROBLEMA: Suponiendo que el ancho natural de una línea espectral a la que le corresponda una longitud de onda de 4500 Å sea igual a 10-4 Å, determínese cuál será el tiempo de vida promedio durante el cual el sistema atómico permanecerá en el estado excitado.
Siendo el ancho natural de la línea espectral igual a la incertidumbre ΔE en la energía, a partir de la relación para la energía de un fotón E = hf podemos obtener a ΔE en función de la longitud de onda del fotón de la siguiente manera:

De la definición del ancho natural de la línea ΔE = Γ0 = ħ/2Δτ podemos escribir lo siguiente:

Metiendo números:
Δτ = (4500×10-10 metro)²/[4π(3×108 metros/seg)(10-14 metro)]
Δτ = 5.37×10-9 segundo
PROBLEMA: Sabiendo que el ancho natural de energía del estado excitado de un sistema es de 2 eV, obténgase el promedio de duración del sistema en ese estado.
Γ0 = ħ/2Δτ
Δτ = ħ/2Γ0 = h/4πΓ0
Δτ = (4.136×10-15 eV·seg)/(4π×2 eV)
Δτ = (1.65×10-16 segundo
PROBLEMA: Una partícula reposa sobre una mesa horizontal plana en presencia de un campo gravitacional. La energía de la partícula a una altura z de la mesa es:
E = mgz + p²/2m
siendo z = 0 para la mesa. Clásicamente, para esta partícula la energía mínima es E = 0. Supóngase que la partícula se mueve en un rango muy pequeño Δz arriba de z = 0. Desígnese a la altura promedio de la partícula como z y considérese que el principio de incertidumbre aplica de la manera usual:
ΔzΔp ≥ ħ/2
Escríbase la energía promedio E de la partícula en función de la altura z y demuéstrese que el valor mínimo de la energía de la partícula no es igual a cero como esperaríamos clásicamente sino que tendrá el siguiente valor:

siendo zmin = (1/2)(ħ²/2m²g)1/3. Calcúlense asimismo los valores numéricos de zmin y deEmin tanto para una masa de 10-6 gramo como para la masa del protón y del electrón.
La expresión clásica para la energía promedio E escrita en función de los valores promedio de la altura z y del momentum p será:

En lo que respecta a la incertidumbre en el momentum, considerando el cuadrado σp² de la incertidumbre σp tenemos lo siguiente:
σp² = p² - p²
Este problema puede ser visualizado considerando a la partícula rebotando sobre la mesa desde z = 0 hasta z = Δz, en cuyo caso el promedio del momentum p es igual a cero porque la partícula se encuentra moviéndose la mitad del tiempo en una dirección (momentum positivo) y moviéndose la mitad del tiempo en otra dirección (momentum negativo), dando un promedio de cero. Entonces, con p = 0:
σp² = p²
o bien, revirtiendo a la notación clásica para el principio de incertidumbre:
(Δp)² = p²
Puesto que Δz es igual al doble de la media aritmética de z, o sea Δz = 2z, del principio de incertidumbre tenemos que:
ΔzΔp ≥ ħ/2
Δp ≥ ħ/2Δz
Δp ≥ ħ/4z
De este modo:

La condición del mínimo para se encuentra haciendo dE/dz = 0 en esta última relación:

Despejando para z obtenemos el valor correspondiente de zmin:
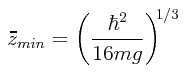
Entonces el valor mínimo posible Emin de la energía promedio E será:

Por substitución directa, encontramos que los valores numéricos tanto de zmin como deEmin para una masa de 10-6 gramo resultan ser:
zmin = 0.411·10-17 metro
Emin = 6.1·10-26 joule
Para un protón estos valores resultan ser:
zmin = 4.09·10-6 metro
Emin = 1.05·10-31 joule
Y para el electrón los valores resultan ser:
zmin = = 4.38·10-4 metro
Emin = 5.87·10-33 joule
PUBLICADO POR ARMANDO MARTÍNEZ TÉLLEZ

No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.